2023年4月11日,南京医科大学基础医学院生物化学与分子生物学系韩晓、陈芳教授团队在《自噬》(Autophagy)杂志在线发表题为《糖皮质受体的激活促进糖脂毒性所致胰岛β细胞自噬过载》(NR3C1/Glucocorticoid receptor activation promotes pancreatic β-cell autophagy overload in response to glucolipotoxicity)的研究论文,提出糖皮质激素受体(以下简称NR3C1)可能是启动胰岛β细胞自噬过度的“开关”,揭示了NR3C1/肥胖相关基因(fat mass and obesity associated protein, FTO)轴介导的过度自噬诱发β细胞功能损伤并引发糖尿病的分子机制,并发现了FTO小分子抑制剂Dac51具有防治这种过度自噬的作用,为糖尿病治疗提供了新思路。
糖尿病是当前严重危害人类健康的主要慢性疾病之一,β细胞功能缺陷是该疾病发生发展的核心环节,如何防治β细胞损伤是长期困扰糖尿病研究领域的重要问题。自噬是由多个自噬相关基因(autophagy-related genes,ATGs)参与调控的胞内分解代谢过程,由于其机制的复杂性,自噬在包括胰岛的绝大多数组织器官中饰演“双刃剑”角色:一方面,自噬可清除β细胞内胰岛淀粉样多肽等毒性蛋白,保证胰岛素的正常合成与分泌;另一方面,持续高度活跃的自噬会造成胰岛素颗粒等β细胞必需细胞成分的过度降解,导致β细胞损伤,是2型糖尿病功能性β细胞数量减少的诱因之一。自噬在β细胞中究竟何时起损伤作用、何时起保护作用,是2型糖尿病发生发展过程中的一个重要的科学问题。
糖尿病前期出现的高血糖及脂代谢紊乱是损伤β细胞功能的主要危险因素,称为糖脂毒性(glucolipotoxicity)。研究发现,尽管多种因素(比如单纯高糖或高脂)均可不同程度地增强β细胞自噬,但仅在糖脂毒性导致β细胞NR3C1持续激活时,过度自噬的“开关”才被打开;通过抑制NR3C1激活或阻断过度自噬关闭此“开关”,可明显减轻糖脂毒性所致β细胞损伤。接着,课题组利用转录组学及RNA甲基化组学深入解析了NR3C1在β细胞过度自噬中的作用机制,发现NR3C1通过激活RNA去甲基化修饰酶FTO,导致β细胞内ATG5、ATG9a、ATG12、ATG16l2等众多自噬相关基因mRNA的N6-甲基腺苷修饰(m6A)锐减、mRNA半衰期延长、表达量增多;而给予FTO的小分子抑制剂Dac51可显著缓解胰岛β细胞NR3C1过表达小鼠β细胞自噬的过度激活,并对该小鼠后续出现的胰岛素分泌不足、血糖升高、糖耐量受损等起到改善作用。
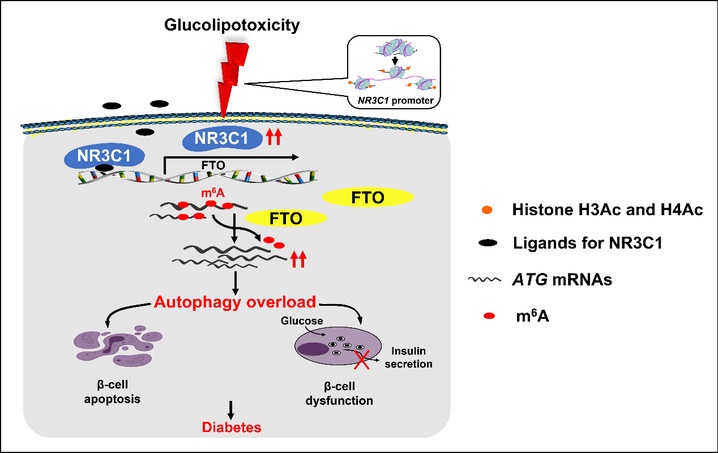
综上,本研究揭示了糖皮质激素受体的激活在糖脂毒性所致β细胞自噬过载和2型糖尿病胰岛β细胞功能缺陷发生机制中的关键作用,并为开发FTO抑制剂用于降血糖及治疗糖尿病提供了潜在靶标。
此项工作由南京医科大学基础医学院韩晓、陈芳课题组完成,南京医科大学副教授吴倜珺为第一作者。该课题获得国家自然科学基金重点项目及面上项目、江苏省自然科学基金等的资助,并获得天津第一中心医院王树森教授的大力支持。
原文链接:
https://www.tandfonline.com/doi/abs/10.1080/15548627.2023.2200625?journalCode=kaup20